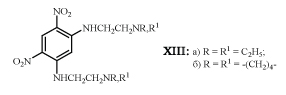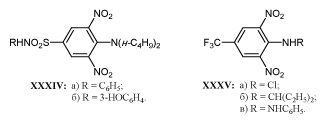19.01.2016: В настоящем обзоре приведены результаты изучения биологически активных соединений с м-ДАГ и примеры использования их в сельском хозяйстве, ветеринарии и медицине.<br />
В сельском хозяйстве соединения с м-ДАГ находят применение в качестве гербицидов, фунгицидов, инсектицидов и акарицидов. Сведения об их активности приведены в нескольких монографиях
Писков В.Б. (научный консультант АО «Щелково Агрохим»), Чернышев В.П. (технический директор АО «Щелково Агрохим»), Каракотов С.Д. (генеральный директор АО «Щелково Агрохим»). Адрес организации: 141101, Россия, Московская область, г. Щелково, ул. Заводская, д.2
Приведены данные биологической активности соединений с м-динитроароматической группировкой (м-ДАГ). Сделан вывод о перспективности включения этой группировки в структуру создаваемых биологически активных препаратов. Установлена возможность замены одной нитрогруппы в м-ДАГ на трифторметильную, без потери биологической активности у полученного аналога.
Ключевые слова: м-динитроароматическая группировка, биологически активные соединения.
В настоящем обзоре приведены результаты изучения биологически активных соединений с м-ДАГ и примеры использования их в сельском хозяйстве, ветеринарии и медицине.
В сельском хозяйстве соединения с м-ДАГ находят применение в качестве гербицидов, фунгицидов, инсектицидов и акарицидов. Сведения об их активности приведены в нескольких монографиях /1-4/.
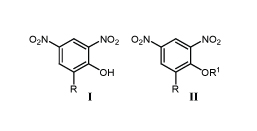
Одним из первых соединений с м-ДАГ, нашедших практическое применение для уничтожения сорняков, были 2,4-динитрофенолы I (табл.1).
|
Соединение |
Заместители |
Название |
ЛД50 мг/кг |
||
|
R |
R1 |
крысы |
мыши |
||
|
Iа |
H |
H |
2,4-ДНФ |
30-70 |
72 |
|
Iб |
CH3 |
H |
ДНОК |
25-50 |
16-47 |
|
Iв |
CH(CH3)C2H5 |
H |
Динотерб |
45-62 |
25 |
|
IIа |
CH(CH3)C2H5 |
COOCH(CH3)2 |
Динобутон |
120-142 |
2540 |
|
IIб |
CH(CH3)C2H5 |
COCH=C(CH3)2 |
Бинапакрил |
150-350 |
1600 |
|
IIв |
CH(CH3)C6H11 |
COCH=CHCH3 |
Динокап |
510-180 |
180 |
Диапазон их использования был ограничен посевами зерновых. Соединения были токсичны для пчел, птиц и млекопитающих. В отличие от 2,4-динитрофенола (Iа), его производное бромфеноксим (III) практически не токсичен и используется как листовой гербицид широкого спектра действия, в том числе для уничтожения сорняков зерновых культур /1,2/.
Механизм действия 2,4-динитрофенолов I и их ацилпроизводных II основан на разобщении окислительного фосфорилирования.
При изучении свойства 2,4-динитроэфиров IV разобщать процесс циклического фосфорилирования выявлены соединения IVа,б, перспективные для использования в качестве гербицидов. Установлено, что биологическая активность 2,4-динитроэфиров IV пропорциональна их липофильности и объему заместителя R в орто-положении /5,6/.
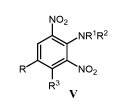
В настоящее время для уничтожения сорных растений в посадках луговых, зерновых, бахчевых и садовых культур интенсивно применяют высокоактивные и нетоксичные 2,6-динитроанилины V (таблица 2).
|
Сое-дине-ниеа |
Заместители |
Название |
LD50 мг/кг (крысы) |
СК50б мг/л (рыбы) |
Объект применения |
Норма расхода кг/га |
||
|
R |
R1 |
R2 |
||||||
|
Vа |
CH3 |
H |
CH(C2H5)2 |
Стомп |
1,1 |
0,14-0,3 |
Хлопчатник |
1-2 |
|
Vб |
CH(CH3)2 |
C3H7 |
C3H7 |
Изопропалин |
5,0 |
0,12-0,15 |
Перец, бобовые |
1,1-2,3 |
|
Vв |
CF3 |
C2H5 |
C2H5 |
Динитрамин |
3,0 |
... |
Соя, подсолнечник |
0,4-0,8 |
|
Vг |
CF3 |
C3H7 |
C3H7 |
Трефлан |
3,5 |
0,01-0,07 |
Лен, овощные культуры |
1,6-3,5 |
|
Vд |
SO2 NH2 |
C3 H7 |
C H7 |
Оризалин |
10,0 |
... |
Соя, картофель |
1-2 |
|
Vе |
SO2CH3 |
C3H7 |
C3H7 |
Нитралин |
4,5 |
28,0 |
Томаты, капуста |
0,5-1 |
Примечание. а) Для всех соединений R3=H, кроме Va R3= CH3 и Vв R3=NH2; б) СК50 - смертельная концентрация для 50% рыб.
Предложены синергидные смеси 2,6-динитроанилинов V с производными изоникотиновой кислоты VI и VII /7,8/.
Механизм избирательного действия м-динитроанилинов V, подавляющих митоз клеток, основан на их способности вступать в взаимодействие с α и β субъединицами тубулина растений, но не животных, препятствуя образованию микротрубочек /9/.
о-Ацил-2,4-динитрофенолы II менее токсичны, чем соответствующие фенолы I, известные как контактные фунгициды (табл.1). Ацилфенол IIв (динокап) часто применяют для обработки плодовых, овощных и ягодных культур. Токсичность препарата для крыс колеблется от 510 до 3100 мг/кг и зависит от количества присутствующих в нем изомеров /3/.
Изучение фунгицидной активности около двухсот 2,6-динитроанилинов V привело к неожиданному выводу, что наиболее активными оказались гербициды динитрамин Vв и оризалин Vд /10,11/.
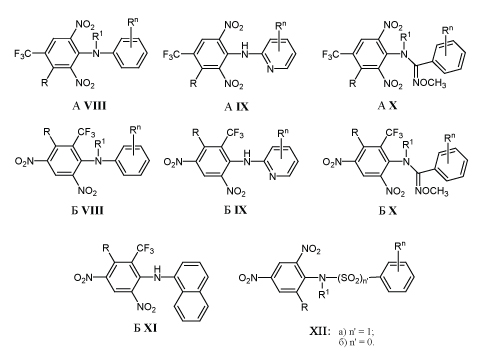
Особенно интенсивно исследовали возможность использования 2,6-динитроанилинов А VIII, А IX, А X, а также 2,4-динитроанилинов Б VIII, Б IX, Б X, Б XI и XII для подавления развития различных видов фитопатогенных грибов /12-18/.
Наиболее активные аналоги указаны в табл.3. На практике применяют 2,6-динитроанилин А IXа (флуазинам). Высокая фунгицидная активность препарата сочетается с относительно низкой токсичностью для животных и птиц /1,15/.
Многие замещенные 2,4 и 2,6-динитроанилины А IX, X и Б VIII-XI способны подавлять жизнедеятельность насекомых и клещей, паразитирующих на растениях (табл. 3). Например, 2,4-динитродифениланилин Б VIIIг в виде 0,0001% раствора уничтожает 99-100% клещей, паразитирующих на фасоли /13/ 2,4-динитродифениламин Б VIIIг (фентрифанил) широко применяют против растительноядных клешей на полях зерновых, овощных и садовых культур /14/.
С той же целью используют и упомянутые выше о-ацил-2,5-динитрофенолы IIа-в /1-4/. Механизм действия замещенных 2,4 и 2,6-динитроанилинов А, Б VIII-XI и XII, как и 2,4-динитрофенолов I объясняют способностью разобщать процесс окислительного фосфорилирования в митохондриях /1,22/.
|
Cоеди-нение |
Фунгициды |
Лите-ратура |
Соеди-нение |
Инсектициды, акарициды |
Лите-ратура |
||||
|
R |
R1 |
Rn |
R |
R1 |
Rn |
||||
|
А VIII a |
Cl |
H |
3-Cl 5-Cl |
12 |
А IXб |
H |
H |
3-CL 5-Cl |
15 |
|
Б VIII a |
H |
H |
2-Cl 4-CF3O |
13 |
Б Xб |
H |
H |
3-CF3 |
16 |
|
Б VIII б |
H |
H |
2-Cl 5-Cl |
14 |
Б VIIIв |
H |
CH3 |
2-F 4-F |
29 |
|
А IX a |
Cl |
H |
3-Cl 5-CF3 |
15 |
Б VIIIг |
H |
Y |
2-Cl 5-CF3 |
14 |
|
Б IX a |
H |
H |
3-Br 5-CF3 |
15 |
Б VIIIд |
H |
H |
2-Cl 4CF3O |
13 |
|
А X a |
H |
H |
4-CF3 |
16 |
Б VIIIе |
H |
H |
2-F 5-F |
19 |
|
Б X a |
H |
H |
4-CF3 |
16 |
Б IXб |
H |
H |
3-Cl 5-CF3 |
15 |
|
XII a |
H |
CH3O |
4-Cl |
17 |
Б Xа |
H |
H |
4-CF3 |
16 |
|
XII б |
NO2 |
H |
3-CF3 3-CF3 |
18 |
Б XIа |
H |
H |
4-CN |
21 |
Область применения соединений с м-ДАГ не ограничивается сельским хозяйством. Проводится поиск соединений, пригодных для борьбы с возбудителями инфекционных и паразитарных заболеваний человека и животных.
Установлено, что фенилендиамины XIII проявляют выраженное противовирусное действие.
Пятикратное введение фенилендиамина XIIIа в количестве 16,5 мг/кг вдвое сокращает число легочных поражений у мышей, зараженных вирусом гриппа, а однократное - в дозе 250 мг/кг - приводит к выздоровлению 70% мышей, инфицированных вирусом энцефаломиокардита, независимо от того, вводили XIIIа за сутки до или после заражения. Сходные результаты получены и при лечении мышей, заболевших вирусным гепатитом, с помощью XIIIб. Повторное введение препарата не улучшало лечебный эффект. Авторы приходят к выводу, что механизм действия фенилендиаминов XIII сводится к усилению выработки интерферона в организме животного /23/.
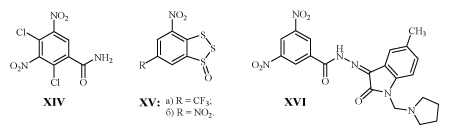
В результате изучения in vitro большого количества соединений с м-ДАГ выделен амид XIV, высокоактивный не только против вируса иммунодефицита человека, но и в 35 раз менее токсичный для клеток хозяина /24,25/.
В качестве эффективного ингибитора репродукции ВИЧ запатентован 1,2,3-бензотритиол-1-оксид XVа /26/.
Учитывая возможность замены CF3-группы на NO2 без потери биологической активности, представляет интерес испытание его аналога XVб.
Гидразон XVI успешно защищает от гибели эмбрионы цыплят, инфицированных различными штаммами вирусов /27/.
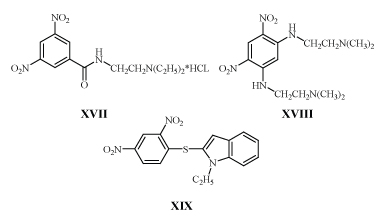
Соединения с м-ДАГ обычно недостаточно активны против грамположительных и грамотрицательных бактерий, но эффективно подавляют развитие микобактерий. Первые сообщения о таких соединениях XVII-XIX не привлекли должного внимания /23,28,29/.
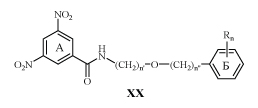
Широкие исследования в этой области начались с изучения противотуберкулезной активности большого количества N-монозамещенных амидов XX.
Аналоги с такими заместителями как F, Cl, CF3, и CF3 O действуют в концентрации менее 5 мкм/л /30/.
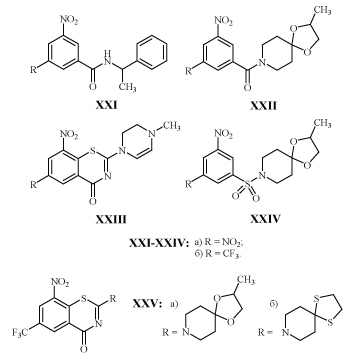
Свойство подавлять развитие микобактерий характерно и для других амидов с м-ДАГ: XXI, XXII, тиазинонов XXIII, и сульфонамидов XXIV.
Активность некоторых из них приведена в табл. 4, из которой следует, что вполне возможна замена одной нитрогруппы - трифторметильной, а карбоксамидной - сульфонамидной без потери активности новых аналогов.
|
Соединение |
R |
МИК мкм/л |
Штамм микобак-терий |
Литература |
|
XXIa |
NO2 |
0,25 |
H37 Rv |
31 |
|
XXIб |
CF3 |
0,95 |
H37 Rv |
31 |
|
XXIIa |
NO2 |
0,80 |
H37 Rv |
31 |
|
XXIIб |
CF3 |
50,0 |
H37 Rv |
31 |
|
XXIIIa |
NO2 |
0,20 |
H37 Ra |
32 |
|
XXIIIб |
CF3 |
0,10 |
H37 Ra |
32 |
|
XXIVа |
NO2 |
1,53 |
H37 Rv |
33 |
|
XXIVб |
CF3 |
6,99 |
H37 Rv |
33 |
Бензотиазиноны XXVа,б подавляют рост микобактерий в разведении до 0,002 и 0,0001 мкм/л /32/.
Из большого числа синтезированных ксантонов XXVI только XXVIа-в способны угнетать развитие микобактерий в дозе 0,125-2 мкм/мл /34,35/.
Механизм действия соединений XX-XXVI основан на активации их с помощью декапренилфосфорил-β-D-рибозо-21-эпимеразы до соответствующего нитропроизводного, которое ковалентно связывается с SH-группой этого же фермента, инактивируя его, что приводит к нарушению синтеза арабинозы, необходимой для построения оболочки микробной клетки и, как следствие, ее лизису /36,37/.
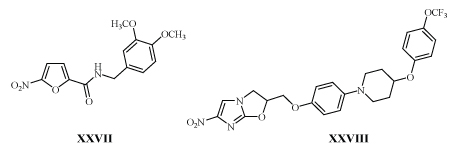
2-Нитрофуран XXVII и 4-нитроимидазол XXVIII также высоко активны против микобактерий /38-41/. Как и соединения с м-ДАГ они являются пролекарствами, но с иным механизмом действия.
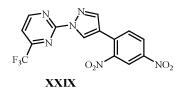
В клетке под действием глюкозо-6-фосфатдегидрогеназы из XXVII и XXVIII образуется окись азота, которая прекращает синтез миколевых кислот, что приводит клетку к гибели /40,42/. Из многих 1,3-замещенных пиразолов только аналог с м-ДАГ (XXIX) подавляет рост туберкулезных бактерий, устойчивых к действию изониазида и рифампицина в дозе 125 мкм/л /43,44/.
Пиразол XXIX тормозит эноилацилредуктазу микобактерий, участвующую в синтезе высокомолекулярных жирных кислот, необходимых для построения липидной оболочки клетки. Действие XXIX высоко избирательно, т.к. подобная ферментная система у человека отсутствует /44/.
Соединения с м-ДАГ эффективны и при заболеваниях, вызываемых простейшими.
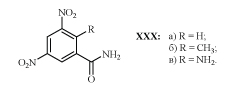
Сообщения об активности амида XXXа (ДНБА) при кокцидиозе птиц стало началом интенсивного изучения его многочисленных аналогов /45-55/. В практике птицеводства нашли применение амид XXXб (зоален) и амид XXXв (ирамин) /47,50/.
Следует отметить, что зависимость между строением аналогов ДНБА и активностью при кокцидиозе аналогична установленной для соединений с м-ДАГ, активных при туберкулезе. Например, аналоги ДНБА, полученные заменой нитрогруппы на трифторметильную или амидной на сульфонамидную, обладают кокцидиостатическим действием /31,36,55/.
Исследование анион радикалов аналогов ДНБА показало, что для активных соединений характерно наличие повышенной плотности неспаренного электрона в положении 6 /56-58/.
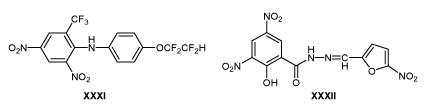
Дифениламин XXXI, отличающийся по строению от аналогов ДНБА, также предохраняет птиц от заболевания кокцидиозом при скармливании в дозе 30-50 мг/кг корма /59/.
Для профилактики и лечения гистомоноза индеек применяют гидразон XXXII (нифурсол), активный в дозе 75-200 мг/кг корма /60-62/. Аналоги нифурсола с одной нитрогруппой в кольце не активны /63/.
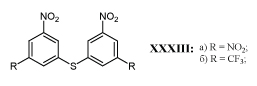
Разработан метод отбора соединений с м-ДАГ, обладающих противомалярийным действием. Метод основан на способности таких соединений более избирательно подавлять активность тиоредоксинредуктазы плазмодия. В результате отбора был выделен м-динитросульфид XXXIIIа, подавляющий активность тиоредоксинредуктазы плазмодия в дозе 0,5 мкм/мл, в 8 раз более активно, чем тиоредоксинредуктазу человека. Аналог XXXIIIб, полученный заменой нитрогруппы на трифторметильную группу менее активен /64/.
Пиразол XXIX не только ингибирует эноилацилредуктазу микобактерий, но и малярийного плазмодия, подавляя клетки P.falciparum, устойчивые к другим антималярийным препаратам, в разведении до 21,2-22,6 мкм/л /44/. сходную активность отмечают и у ДНБА /65/.
В опытах на культуре клеток, инфицированных возбудителями лейшманиоза, токсоплазмоза или саркоптоидоза выявлены высокоактивные 2,4-динитроанилины XXXIVа,б и XXXVа-в.
Эти соединения, как и близкие к ним по строению гербициды оризалин Vд и трифлуралин Vг, активируясь внутри клеток паразита, подавляют образование тубулина из α- и β-субъединиц /66-68/.
м-Динитрофенилендиамины XIII обладающие противовирусным действием, оказались активны и при амебиазе. После применения фенилендиамина XIIIа в дозе 75 мг/кг у хомяков полностью исчезали некрозы в печени /23/.
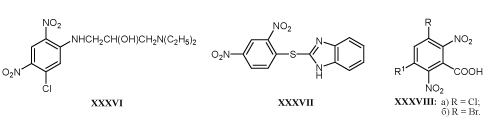
Сведения о противогрибковой активности соединений с м-ДАГ незначительны. Некоторые из них XXXVI и XXXVII способны подавлять развитие патогенных грибов в разведении 5-25 мкг/мл /23-29/.
Сообщения о возможности использовать замещенные бензойные кислоты XXXVIIIа,б для лечения людей, пораженных микозами, не подтверждено экспериментальными данными /69/.Изучение антгельминтного действия многих нитро- и динитро-ароматических соединений не выявило препаратов, представляющих практический интерес /23/. Исключением стало сообщение о высокой шистосомоцидной активности аминотиофенов XXXIXа,б, которые рекомендуют применять для лечения людей, заболевших бильгарциозом в дозе 25 мг/кг /70,71/.
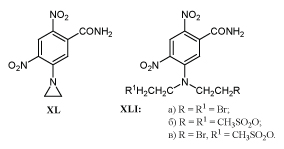
Сообщение о противоопухолевой активности м-динитробензамида XL /72/ положило начало изучению его изомеров /73/ и многочисленных аналогов /74-78/.
Установлено, что изомеры XL с двумя нитрогруппами, расположенными в орто-или пара-положении относительно друг друга, аналоги с одной нитрогруппой или аналоги, полученные заменой одной нитрогруппы на метилсульфонильную - практически не активны /74,78/. В присутствии кислорода воздуха амиды XL и XLI относительно не токсичны, однако в условиях гипоксии , в которых находятся раковые клетки, эти соединения под действием нитроредуктаз превращаются в высоко токсичные продукты, инактивирующие ДНКА опухолевых клеток, приводя их к гибели /75,79,80 /.
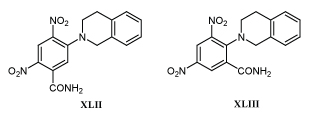
Неожиданным оказалось сообщение о том, что амид XLII и его изомер XLIII, не имеющие биологически активной этилениминовой группировки, в 7-9 раз сильнее подавляют диафоразу опухолевых клеток человека, чем динитробензамид XL /81/.
Описана высокая противоопухолевая активность пикрилхлорида XLIV и гидрозила XLV. После подкожного введения мышам раствора XL в концентрации 10 моль/л большая часть животных освобождается от опухолей.
Хороший терапевтический эффект получен при лечении людей с раковыми заболеваниями 3-ей степени после одной-двух инъекций раствора гидразила XL в разведении 10 моль/л. Полагают, что указанные соединения являются катализаторами выработки свободных радикалов, под действием которых в клетке образуются высокотоксичные продукты, приводящие ее к гибели /82/.
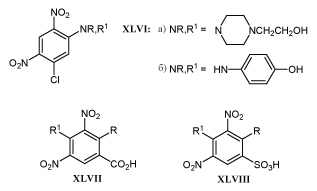
Способность подавлять рост опухолей свойственна не только пикрилхлориду, но и другим соединениям с м-ДАГ, содержащим подвижный атом хлора: анилинам XLVI, замещенным бензойной и бензолсульфокислотам XLVII, XLVIII.
Анилин XLVIа в дозе 39 мг/кг на 91% тормозит рост карциномы Эрлиха у мышей после 5 инъекций. К концу опыта до 60% животных полностью освобождаются от опухолей. Сходный эффект дает использование бензойной кислоты XLVIIа в дозе 75 мг/кг при лечении мышей с имплантированной саркомой М5076. Применение сульфокислоты XLVIIIб в дозе 100 мг/кг более чем в 4 раза продляет жизнь животного с аденокарциномой МАС 15А. Механизм действия указанных соединений объясняют способностью активировать защитные силы организма /23/.
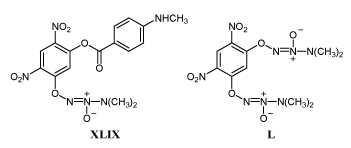
Диазениумдиолаты XLIX и L избирательно подавляют пролиферацию раковых клеток.
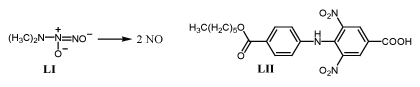
Полагают, что под действием глутатионтрансферазы от них отделяется анион LI, который быстро распадается с образованием двух молекул окиси азота /83-85/.
Сообщают, что м-динитробензойная кислота LII способна подавлять митоз клеток хронической лейкемии в разведении 1,08 мкм/л /86/.
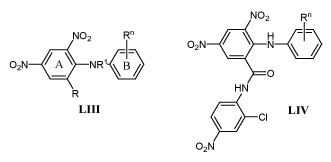
Выяснение биологической активности соединений с м-ДАГ обычно сопряжено с определением их токсичности. Например, подробно изучена токсикология м-динитрофенолов I, применяемых в качестве гербицидов /87,88/. В ходе работ по поиску препаратов, активных против фитопатогенных грибов среди дифениламинов LIII, выяснилось, что многие из них высокотоксичны для грызунов /89,91/.
Установлена связь между строением и родентицидной авктивностью в ряду дифениламинов LIII. Аналоги с R = СF3 токсичнее аналогов с R = NO2, с R = Сl, CH3, COOH, COOCH3 и SO2NH2 мало токсичны.
Крысы поедают с кормом только N-алкилдифениламины LIII. Для уничтожения грызунов используют N-метил-2,4-динитро-6-трифторметил-2,4,6-трибромдифениламин (брометалин), действующий в концентрации 0,005-0,01%, в 2,5 раза сильнее, чем на мышей /91/. Родентицидным действием обладают и близкие по строению 3,5-динитроантраниланилиды LIV /92/. Однако, между этими группами соединений существуют определенные различия. 3,5-Динитроантранилиды LIV значительно токсичнее для мышей и полевок, чем для крыс, и хорошо поедаются с кормом. Высоко токсичны аналоги, содержащие не только два или три, но и один заместитель в кольце Б. Например, все мыши погибают за один-два дня после поедания корма с анилидом LIV (Rn=4-F) в количестве 0,005%.
Механизм токсического действия м-динитродифениламинов LIII и 3,5-динитроантраниланилидов LIV основан на разобщении процесса окислительного фосфорилирования в митохондриях клеток центральной нервной системы. Это приводит к усилению давления цереброспинальной жидкости на аксоны, ослаблению нервного импульса, параличу и смерти животного. /91,93/.
Опубликованные данные по токсичности нитро и динитроароматических соединений для различных видов птиц /94/, а также результаты изучения генотоксических свойств таких соединений /95,96/.
Сведения о токсичности соединений с м-ДАГ приводят в работах по созданию эмпирических формул, позволяющих предсказывать токсичность, не прибегая к опытам на животных /97-100/.
Приведенные в обзоре примеры биологической активности соединений с м-ДАГ, часть из которых нашла применение в сельском хозяйстве, ветеринарии и медицине, служит подтверждением перспективности использования этой группировки при создании новых пестицидов и лекарственных препаратов. Обращено внимание на возможность замены одной из двух нитрогрупп м-ДАГ на трифторметильную группу.
Список литературы
1. К.В. Новожилов, В.И. Долженко, Средства защиты растений, ООО Агрорус, Москва (2011).
2. Weed Management Handbook, R.E.L. Naylor (ed.), Ninth.Ed., Blackwell Publ., (2002).
3. Handbook of Pesticide Toxicology, R.I. Krieger (ed.), vol.1 et vol. 2, 2nd, Acad.Press, San-Diego, San-Francisco, New York (2001).
4. Н.Н. Мельников, К.В. Новожилов, С.Р. Белан, Пестициды и регуляторы роста растений, Химия. Москва (1995).
5. W. Oettmeier, K. Masson and A. Donner, Z. Naturforsh, 42c, 705-708 (1988).
6. S.J. Coughlan, Biochim.Biophys.Acta, 933, 413-422 (1988).
7. P. Foessel, патент США, 6890887. (2005).
8. D. Larelle, G.L. Cardon and R.K. Mann, патент США 8153556.
9. А.И.Емец, У.В. Баярд, А.Ю. Ныпорко и др., Цитология и генетика, (5), 69-75 (2009).
10. J.R. Beck and J.A. Yahner, патент США 4259347.
11. P. Bohus, F. Bihari, M. Kertesz et al. Патент США 4806151.
12. B.A. Dreikorn, патент США 4152460.
13. A. Hartmann, E. Klauke, I. Hamman et al., патент США 4459304.
14. J.D. Hunt and F.C. Peacock, патент США 4128665.
15. R. Nishiyama, K. Fujikawa, T. Haga et al., патент США 4331670.
16. M. Kern, W. Knauf, K. Matterstok et al., патент Германии DE3802175.
17. Wo 0065913. (2000).
18. B.A. Dreikorn, патент США 4381312.(1983).
19. C.B. Barlow and P.E. Freeman, патент США 4117167.(1978).
20. B.A. Driekorn and K.E. Kramer, патент США 4407820.(1983).
21. A.J. Clinton and J.O. Doherty, патент США 4423065.(1983).
22. С.А. Тютерев, Механизм действия фунгицидов на фитопатогенные грибы, РАСХН, Санкт-Петербург, с.20.(2010)
23. E. Winkelmfnn, W. Raether, W. Ditmar et al., Arzneim Forsch., 25, 681-708 (1975).
24. W.O. Ayuko, WO 9427584. (1994).
25. W.O. Ayuko, WO 9524897. (1995).
26. Т.М. Хоменко, К.П. Волчо, А.Г. Покровский и др. Патент РФ, №2366419.
27. A. Pande, S. Agarwal, Y.K.Saxena et al., Indian J.Pharm.Sci.49(3), 85-88(1987).
28. B.И. Зайонц, Г.С. Волынская, Л.А. Коровицкая и др., Хим.-фарм.журн., 9 (4) 18-20 (1975).
29. M. Lacova, F. Volna and Z. Odlerova, Chem.Zvesti, 36(5) 709-715 (1982).
30. P. Brodin, T. Christophe, J. Kim et al., WO 2010/003533.
31. R. Tiwari, J.C. Moraski ,V. Krchnak et al., J.Amer.Chem.Soc, 135, 3539-3549 (2013).
32. Chao Jao, Ting-Hong Ye, Ning-Yu Wang et al., Bioorg.Med.Chem.Lett, 23 (17), 4919-4922 (2013).
33. R. Tiwari, U. Mollenmann, S. Cho et al., ACS Med.Chem.Lett., 3, III (2014). 34. M. Pickert, K.J. Schaper and A.W. Frahm, Arch.Pharm.Med.Chem., 331, 193-197 (1998).
35. W.J. Ibrom, K.J. Schaper and A.W. Frahm, Arzneim.Forsch., 47, 767-773(1997).
36. C. Trefzer, M. Rengifo-Gonzalez, V.J. Hinner et al., J.Amer.Chem.Soc., 132, 13663-13665 (2010).
37. C. Trefzer, H. Skovierova, S. Buroni et al., J.Amer.Chem.Soc., 135, 3539-3549 {2013).
38. R.P. Tangallapally, R.Yendapally, R.E. Lee et al., J.Med.Chem., 48, 8261-8269 (2005).
39. N.R. Tawari and M.S.Degani, J.Comput.Chem. 31, 739-751 (2010).
40. P. Kim, L. Zhang, U.H. Manjuhatha et al., J.Med.Chem., 52, 1317-1328 (2009).
41. P. Kim, S. Kang, H.I. Boshoff et al., J.Med.Chem., 52, 1329-1343 (2009).
42. E.C. Rivers, R.L. Mancera, Curr.Med.Chem., 15, 1956-1967(2008).
43. M.M. Staveski and S.F. Sneddon, WO 0156974.(2001).
44. M.R. Kuo, H.R. Morbidoni, D. Alland et al., J.Biolog. Chem., 278 (23) 20851-20859 (2003).
45. N.F. Morehouse and W.C. McGuire, Poultry Sci., 36(5), 1143-1147 (1957).
46. N.F. Morehouse and W.C. McGuire, Poultry Sci., 36 (5), 38(1),410-416 (1959).
47. L.P. Joyner, Res. Veterin.Sci., 1 (4), 363-367 (1960).
48. H. Hymas and J. Stevenson, Poultry Sci., 39 (5), 1261-1262 (1960).
49. D.E. Welch, R.R. Baron and B.A. Burton, J.Med.Chem., 12, 299-305 (1969).
50. И.А. Коблова, А.И. Шмулевич, В.Б. Писков, Тр. Гос.научно-контр.ин-та ветпрепаратов, Москва (1969) 16, 316-319.
51. В.Б. Писков, Л.К. Осанова, Л.К. Педенчук и др. там же, 17, 303-318 (1971).
52. В.Б. Писков, В.П. Касперович, И.А. Коблова, там же, 20, 269-274 (1974).
53. В.Б. Писков, В.П. Касперович, И.А. Коблова, там же, 21, 228-232 (1975).
54. И.А. Коблова, В.Б. Писков, там же, 25, 233-237 (1977).
55. И.А. Коблова, В.Б. Писков, Химия в сельском хоз-ве., 11(7), 71-74 (1973).
56. В.Б. Писков, В.М. Казакова. И.А. Коблова. Тр. Гос. научно-контр. ин-та ветпрепаратов, Москва (1972), 18, 357-360.
57. В.М. Казакова, Н.Е. Минина, И.Г. Макарова и др. Журн. Структурной химии. 17 (4), 615-619 (1976).
58. В.М. Казакова, Н.Е. Минина, В.Б. Писков, ЖОХ, LII, 961-967 (1982).
59. A.J. Clinton, патент США, 4311710 (1982).
60. T.W. Sullivan, R.J. Mitchel and O.D. Grace, Poultry Sci, 52 (6), 1956-1958 (1972).
61. И.А. Коблова, Б.А. Тимофеев, О.Ф. Бондаренко и др., Ветеринария, №1, 71-73 (1974).
62. И.А. Коблова, Б.А. Тимофеев, В.Б. Писков, Ветеринария, №1, 66-68 (1976).
63. E.W. Berndt, H. Van Essen , B.G. Held et al., J.Med. Chem.,12, 371-374(1969).
64. A.D. Andricopulo, M.B. Akoachere and R. Krogh, Bioorg.Med.Chem., 16, 2283-2292 (2006).
65. P. Grellier, J. Sarlauskas, Z. Anusevicius et al., Archives Biochem.Biophys., 393 (2), 199-206 (2001)
66. T.G. Gorge, J. Johnsamuel, D.A. Delfin et al., Bioorg.Med.Chem., 14, 5699-5710 (2006).
67. J.W. Benbow, E.L. Bernberg, A. Korda et al., Antimicrob.Agents Chemother., 42, 339-343 (1998).
68. G. Bhattacharya, M.M. Salem, K.A. Werbotetz, Bioorg.Med.Chem.Lett., 12, 2395-2398 (2000).
69. V.Z. Gurevich, WO 93/17676 (1993).
70. J. Hellerbach and A.Szonte, патент Швейцарии CH597226 (1978).
71. R. Stohler, Tropenmed. Parasitol., 28, 276-279 (1977).
72. L.M. Gobb, T.A. Connors, L.A. Elsan et al., Biochem. Pharmacol., 18, 1519-1527 (1969).
73. N.A. Helsby, G.J. Atwell, Sh. Yang et al., J.Med.Chem., 47, 3295-3307 (2004).
74. B.D. Palmer, W.R. Wilson, S. Gliffe et al., J.Med.Chem., 35, 3214-3222 (1992).
75. B.D. Palmer, P. VanZijl, W.A. Denny, J.Med.Chem., 38, 1229-1241 (1995).
76. B.D. Palmer, W.R. Wilson, R.F. Anderson et al., J.Med.Chem., 39, 2518-2528 (1996).
77. F. Friedlos, W.A. Denny, B.D. Palmer et al., J.Med.Chem., 40, 1270-1275 (1997).
78. G.J. Atwell, ShYang, F.B. Pruijn et al., J.Med.Chem., 50, 1997-2012 (2007).
79. J.V. Skelly, M. Sanderson, D.A. Suter et al., J.Med.Chem., 42, 4325-4330 (1999).
80. J. Johansson, G.N. Parkinson, W.A. Denny et al., J.Med.Chem., 46, 4009-4020 (2003).
81. Ph.J. Burke, L.Ch. Wong, T.C. Jenkins et al.,Biorg.Med.Chem.Lett, 21, 7447-7450 (2011).
82. W.D. Ayuko, WO 91/15200 (1991).
83. P. Shami, J.E. Saavedra, L.Y. Wang et al., Mol.Cancer Therap., 2, 409-417 (2003).
84. J.E. Saavedra, A. Srinivasan, G.S. Busard et al., J.Med.Chem., 49, 1157-1164 (2006).
85. D. Andrei, A.E. Maciad, H. Chakrapani et al., J.Med.Soc., 51,7944-7952 (2008).
86. M. Botta, V. Corradi, F. Falchi et al., WO 2011101787 (2011).
87. Lawford, King, D.G. Harvey, J.Pharm.Pharmacol., 6, 619-624 (1954)
88. D.G. Harvey, G. Pharm. Pharmacol., 11, 462-474 (1959).
89. B.A. Dreikorn, патент США 4084004 (1978).
90. B.A. Dreikorn, патент США 4187318 ((1980).
91. B.A. Dreikorn and G.O.O`Doherty, Chemtech, July, 424-430 (1985).
92. В.Б.Писков, С.Д.Каракотов, Е.В.Желтова и др. патент РФ 2528419 (2011).
93. VanLier and L.D.Cherry, Fundam. Appl.Toxicol., 11(4) ,664-672 (1988).
94. E.W. Schafer, W.A. Bowles and J. Hurlbut, Arch.Environment.Contam.Toxicol., 12, 355-382 (1983).
95. T. Grummt, H.G. Wunderlich, A. Chakaborty et al., Environment.Mol.Mutagenes., 47, 95-106 (2006).
96. G. Neuwoehner, A. Schofer, B. Erlenkaemper et al., Environment.Toxicol.Chem. 26 (6), 1090-1099 (2007).
97. V.K. Agrawal and P.V. Khadikar, Bioorg. Med.Chem., 9, 3035-3040 (2001).
98. B.E. Kuzmin, E.N. Muratov, A.G. Artemenko et al., J.Comput.Aided.Mol.Des. 22, 747-759 (2008).
99. H.R. Pouretedal and M.H. Keshavazz, J.Iranian Chem.Soc., 8(1) 78-89 (2011).
100. M.H. Keshavars and H.R. Pouretedal, Med.Chem.Res., 22, 1238-1257 (2013).
Получили регистрацию новые гербициды «бетареновой» группы «Щёлково Агрохим»: БЕТАРЕН 320, МД и БЕТАРЕН МАКС, МД. Сахарная и кормовая свёкла – под надёжной защитой от сорняков!
Двухкомпонентный препарат БЕТАРЕН 320, МД (160 г/л десмедифама + 160 г/л фенмедифиама) зарегистрирован против однолетних двудольных сорняков. Его преимущество – увеличенная концентрация двух действующих веществ, чего нет в других препаратах бетаренового ряда. Результатом этого является усиленное гербицидное действие препарата по мари белой, видам щирицы и другим сорнякам.
Трёхкомпонентный гербицид БЕТАРЕН МАКС, МД (126 г/л этофумезата + 80 г/л десмедифама + 64 г/л фенмедифиама) не имеет полных аналогов!
Конкурентное преимущество новинки – повышенная гербицидная активность против однолетних двудольных и некоторых однолетних злаковых видов. Таким образом, БЕТАРЕН МАКС, МД – это идеальная формула для контроля основных сорняков в посевах сахарной и кормовой свёклы!
Новые гербициды БЕТАРЕН 320, МД и БЕТАРЕН МАКС, МД отвечают всем требованиям современной защиты растений. Высокая эффективность против сорняков, включая резистентные виды, сочетается в них с минимальным фитотоксическим воздействием на культуру. А уникальная масляная формуляция, в которой находятся препараты, способствуют достижению наивысшего защитного эффекта в разных погодно-климатических условиях.
Норма применения препаратов БЕТАРЕН 320, МД и БЕТАРЕН МАКС, МД составляет 1,0 -1,5 л/га в зависимости от фазы развития сорных растений. За сезон рекомендовано проводить 2-3 обработки, дробно, малыми дозами.
Встречайте новые гербициды БЕТАРЕН 320, МД и БЕТАРЕН МАКС, МД: мягкие для свёклы, бескомпромиссные для сорняков!